Parent Project Onlus Conference 2018
15. prosince 2018
Heslo tohoto ročníku bylo: Pojďme růst společně. Konference se účastnili zástupci 34 zemí světa, každým rokem se toto číslo zvětšuje (letos nově zástupci z Mexika, Indie, Portugalska a Austrálie). Letošní konference narozdíl od předchozích byla pouze dvoudenní, o to samozřejmě intenzivnější. Během soboty byly prezentovány studie, které jsou nyní v preklinické fázi výzkumu, nebo ve fázi 1 a 2. Během neděle studie ve fázi 3. Mezi prezentacemi farmaceutických firem byly panely věnované zkušenostem rodin z momentu sdělení diagnózy a z přechodu dětské do dospělé péče.
Úvod měla jako každý rok Fernarda De Angelis, vedoucí vědecké sekce Parent Project Onlus, která vysvětlovala, jaké druhy terapie u Duchenna jsou. Farmaceutické firmy se mohou věnovat opravě mutace nebo výrobě substitutu dystrofinu. Genová terapie se snaží o to vytvořit dystrofinový gen a dostat ho efektivně do nukleových kyselin buněk, především virovými vektory. Většinou naráží na ten problém, že virové vektory jsou drobné a nezvládneme do nich dát tak velký gen jako dystrofin, proto většina vyvíjí mikrodystrofin, tedy kratší funkční gen. Buněčná terapie užívá zase kmenové buňky, tedy buňky s nedeterminovanou funkcí, kterých je v těle hodně, i když jen některé mají schopnost se stát svalovými buňkami. Tato terapie si ale žádá dárce, od kterého jsou buňky odebrány, upraveny, kultivovány a teprve poté aplikovány. Přestože má tato terapie velkou budoucnost, zatím je opravdu v plenkách, protože naráží na základní problémy typu, že imunitní systém kmenové buňky po aplikaci rychle zlikviduje. Další možnou terapií je oprava/úprava genu - editace genomu, jako je exon skipping nebo crispr terapie, kdy se snažíme zprovoznit co největší část genu, která je zapsaná správně a přeskočit nefunkční úsek.
Preklinické studie a studie ve fázi 1
AAV9 Minidystrofin Genová Terapie - Pfizer
V naší studii je vektorovým nositelem minidystrofinu adeno-asociovaný virus, o kterém víme, že moc nukleové kyseliny nepřenese, ale zatím nám jednoznačně vychází jako nejvhodnější. Preklinické fáze probíhaly výhradně na krysách. Efekt se jevil jako slibný, s překvapením zjistili, že v některých buňkách je přenos nukleové kyseliny efektivnější, pak se tam produkuje více dystrofinu, např. v srdečních. Potřebují ještě zjistit, proč tomu tak je a jak to ovlivnit. Momentálně chystají klinickou fázi 1, kde zahrnou 12 chlapců, budou u nich sledovat výsledky svalové biopsie a záíkladní biochemii.
Studie, věnující se genové terapii, které právě úspěšně dokončily preklinickou fázi a chystají se začít klinickou fázi 1 probíhají v UCL Institute od Child Health v Londýně, pod vedením Thomase Voita, v Nationwide Children’s Hospital v Ohiu pod vedením Kevina Flanigana a Jerryho Mendella. Kromě úspěchů a nadějí, které jsou do genové terapie vloženy, ale všichni bojují se spoustou nezodpovězených otázek. Např. dystrofin má několik izoforem, podle toho v jaké skupině svalů se tvoří. Mikrodystrofin má ale pouze dvě izoformy, v kosterních svalech a v srdci, na ostatní (oči, mozek) nepůsobí. Také vysoká dávka mikrodystrofinu krásně sníží fibrózu, ale kupodivu v každém svalu jinak efektivně a také nikdo neví proč. A konečně, na to abychom zvýšili svalovou sílu, potřebujeme opravdu vysokou dávku mikrodystrofinu, což zatím také není vyřešeno. Taky víme, že čím dříve začneme dítě léčit, především čím více má svalu v poměru k ostatním orgánům, tím efektivnější. Ale zatím nemáme tak dokonalý screening, že bychom onemocnění zachytili ještě u batolat.
O genové terapii měla přednášku také Pat Furlong, která vede americkou organizaci Parent Project Muscular Dystrophy a která vyjednává především s americkou FDA. Pro FDA se rozhodli připravit studii preferencí, kdy se rodičů a pacientů ptali, co si od léčby nejvíce slibují, co jsou za léčbu ochotni dát, čeho se vzdát, co obětovat. Ptali se na sérii otázek, kde si pacienti a rodiče museli vybrat, jestli by spíš chtěli lék, který v 90% funguje, ale ve 20% je riziko poškození ledvin či zlomemin. Nebo jestli by spíš chtěli lék, který z 20% bude fungovat, ale poškozovat orgány nebude vůbec. Jednoznačně zatím vyšlo, že rodiče nejvíc touží po léku, který zastaví progresi onemocnění. Na konci jara bude mít PPMD schůzku se zastupiteli FDA a budou prezentovat data z výzkumu priorit rodin, tak aby se FDA více řídila preferencemi rodin.
O genomové editaci mluvila Annamieke Aartsma-Rus z Leiden University. Snažila se vysvětlit, proč vyvolala Crispr terapie takové haló. Vysvětlovala, že poškození DNA je naprosto běžná věc, například když jdeme na slunce, UV záření nám působí zlomy DNA. Běžná oprava DNA funguje dvěma způsoby, pokud se buňky dělí, při tvorbě kopie dojde k doplnění z druhé nukleové kyseliny. Pokud se jedná o nedělící se buňky (svalové), tělo užívá lepidlový systém, který úseky spojí. Nicméně je důležité, abychom se zbavili poškozených částí a pak slepili funkční části. O to by se měl postarat CRISPR, což jsou v podstatě GPS navigované nůžky, kterou ustřihnou zmutovanou část a slepí se ta dobrá. Zatím CRISPR zvládá lokální úpravu v konkrétní buňce a hlavně funguje na kultivovaných buňkách a zvířatech, samozřejmě jiná kapitola bude terapie u lidí. Výhoda je, že cílí na opravu DNA ne RNA, tedy mělo by se jednat o celoživotní opravu.
Jak sdělit diagnózu a komunikovat o nemoci s dětmi
Další sekce byla kulatý stůl, kdy rodiče a chlapci vyprávěli svůj příběh od diagnózy dál a mluvili o tom, v čem potřebovali nejvíce pomoct. V Itálii mají ojediněle silnou psychologickou péči, velký tým psychologů. Tento tým je přítomen při sdělení diagnózy a provází rodinu jako součást multidisciplinárního týmu. Každý rok vyšetřují děti na možné kognitivní poruchy, poruchy učení, soustředěnosti. Kromě toho, pokud rodina zavolá Parent Projectu, že potřebuje psychologickou pomoc, tým je okamžitě k dispozici. V dospělosti spolupracují také s psychiatry, pokud je třeba farmakologická pomoc při depresi či úzkostech. Psychologové také jdou s dětmi do školy, vysvětlují ve škole jejich onemocnění, informují učitele, vedení, zařizují spolu se sociálními pracovníky a ergoterapeuty úpravy ve škole nutné pro bezbarierový a pohodlný přístup.
Marco, 10letý chlapec, který vyprávěl o tom, jak se postavil ke svému onemocnění, říká, že si vždycky to, čeho nebyl schopen, vyčítal. Myslel si, že za to může sám, že zlobil, že si zaslouží svoji nemoc. Vinil se, že rodiče s ním mají starosti. Trvalo mu než se rodičům svěřil, v centru péče nic říkat nechtěl, ale moc se mu ulevilo, když s ním o tom sám někdo začal a vysvětlil mu, jak to s takovým onemocněním je. Říká, že mu moc pomohlo, když viděl, že není nemocný sám, že má víc kamarádů, kteří mají stejný problém.
Rodiče říkali, že si detailně vybavují moment, kdy jim byla diagnóza sdělena, všechny drobnosti, prostor, člověka, který je informoval. Psychologové radí si pro moment sdělení diagnózy vybrat co nejklidnější prostor, dát si na to dost času. Pozvat si rodinu brzy po sdělení, aby se mohli zeptat na všechno, co nestihli, nebo si neuvědomili při první schůzce. Rovnou je objednat k psychologovi, tak aby si mohli situaci nechat nejdřív projít hlavou a pak klást otázky a naopak na některé odpovídat.
Fernanda, matka 7 letého chlapce s DMD, zase říkala, že o nemoci chlapci brzy vyprávět nemohli, nedovedli si představit, že by to pochopil, takže vše podávali zábavným způsobem, v dětském světle. Když potřebovali, aby syn nosil noční dlahy, řekli mu, že to jsou speciální boty, které mu přinesou hezké sny a tak je nosil hrdě a rád. Neví, jestli to tak bylo správně, ale u nich to takto fungovalo.
Studie na mladých pacientech
Edasalonexent (CAT-1004) - Catabasis
NF-κB je látka, která ja aktivována ve svalu při mechanickém stresu, vede k degeneraci, zánětu a fibróze. CAT-1004 je látka, která je inhibitorem NF-κB a vede naopak k regeneraci a má velmi dobrý efekt na bránici, srdce a kosterní svaly. Během fáze 2 se neprojevili závažné vedlejší účinky, lék byl dobře tolerován a při stabilní dávce po 36 týdnů bylo patrné zpomalení zhoršení stavu. Zatím byla prokázána bezpečnost léku, minimum vedlejších účinků. Testují na chlapcích od 4-7 let bez steroidů, léky berou 3x denně v tabletkách. Dochází k poklesu biochemických markerů, CK a svalových enzymů, bohužel na MRI zatím výsledek patrný nebyl, dle North Star evaluace mají ale chlapci přes rok stejné výsledky, nezhoršují se. Zjistilo se, že některé svaly NF-κB ovlivňuje a některé ne, zatím nevědí proč. Krásné výsledky vznikají ve studii, kde kombinují Edasalonexent a exon-skipping. Nyní jsou na konci 2. fáze.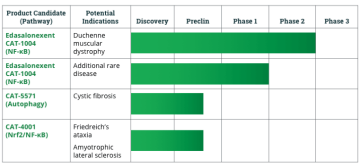
Vamorolone - VBP 15 - ReveraGen
Naším cílem jsou kortikosteroidy bez nežádoucích účinků se stejným protizánětlivým efektem. Kromě těchto efektů má VBP-15 proti steroidům velmi dobrý vliv na srdce a chrání svalovou membránu. Momentálně dokončují open-label studii, ve které titrují dávku léku. Studie probíhá na chlapcích od 4 do 7 let bez steroidů, v USA, Austrálii, Izraelu, Švédsku, Kanadě, UK. Poté bude následovat další fáze, která se chystá i v ČR. 6 měsíců bude 50% chlapců brát Vamorolone, 25% prednison a 25% placebo.
Brave Studie - MNK1411
Jedná se o analog kortikotropinu, což je hormon který zvyšuje produkci kortizolu, ale také působí na skupinu receptorů poškozených svalů, takže podporuje regeneraci svalů. Chlapci ve studii nesmí být na steroidech, věk 4-8 let. Probíhá fáze 2 od začátku roku 2018 a výsledky budou k dispozici na jaře roku 2021.
Studie na starších pacientech
Sarepta Therapeutics
Probíhajících studií Sarepty je momentálně opravdu hodně, v různých fázích vývoje. Exondys 51 je již schválen v USA. Ve fázi I jsou SRP-5051 pro exon 51, 4053-101. Ve fázi II: 4658-102, 4658-203, 4658-204. Ve fázi III: 4045-301, 4658-301. Sarepta Therapeutics bude svou aktuální situaci prezentovat na naší konferenci v Praze.
Summit - Ezutromid
Z dosavadních studií plyne, že Ezutromid je bezpečný lék. Na podzim 2018 budeme mít výsledky současné fáze Phaseout DMD, ve které je 40 pacientů z USA a UK. Na základě výsledků spustíme další fázi. Nyní jsou zapojeni chlapci ve věku 5-10 let. Summit bude také prezentovat aktuální výsledky v Praze.
Rimeporide
Jedná se o inhibitor natriokalciové pumpy, která ovlivňuje otok svalu a při zvýšené hladině calcia způsobuje buněčnou smrt. Hlavně působí kardioprotektivně. Lék má podobný, i když menší efekt než kortikoidy, nicméně nemá významné vedlejší účinky. Dal by se užívat paralelně. Je ve fázi 1, která běží od minulého května, u chlapců od 6 do 14 let, stabilně na kortikosteroidech, schopni polykání, s dostatečnou funkcí ledvin a nesmí být součástí jiné studie. Jedná se o tablety, které se berou třikrát denně.
Domagrozumab - Pfizer
Domagrozumab je molekulární protilátka proti myostatinu. Tato by měla zpomalit progresi nemoci nezávisle na mutaci. Momentálně běží fáze 2, open-label studie. Zahrnuli jsme chlapce od 6-18 let (původně do 10), nicméně chodící na steroidech. Každý měsíc dostávají dvouhodinové infuze, každé 4 měsíce MRI. Průběžné výsledky budou v létě 2018, příští rok proběhne druhý rok fáze 2 a konečné výsledky budou v létě 2019.
Roche-Anti-myostatin
Tato molekula se váže na myostatin a tlumí jeho funkci. Myostatin je tělu přírodní látka, která tlumí příliš velký růst svalů. Fáze 1 zatím prokázala bezpečnost léku. Momentálně probíhá souběžně fáze 1-2 a fáze 2-3, kam jsou pacienti stále přibíráni. Jedná se o intramuskulární injekci jednou týdně. První tři týdny musí být injekce aplikovány v klinickém centru, dále doma. roche-duchenne-clinicaltrails.com
Givinostat
Givinostat je inhibitor histon deacetylázy, která nemá vliv na dystrofin, ale regeneruje svaly a znovu aktivuje faktory, které vedou k regeneraci. Studie Givinostatu je momentálně ve třetí fázi a při dobrých výsledcích by měli být brzy schváleni. Po roce u chlapců od 7-11 - větší procento svalové hmoty, menší procento poškozených svalů a nekrotických svalů - na MRI jasný nález a i klinicky zpomalení progrese. Z nežádoucích účinků je třeba hlídat útlum krevních destiček, který přichází v iniciální fázi léčby, nikdy ale nevedl ke krvácení v důsledku léčby.
Santhera - Idebenone
Santhera má s molekulou Idebenone momentálně 2 studie. Delos je studie u pacientů, kteří nejsou na steroidech. Je dokončena fáze 3. Sideros studie probíhá a je u chlapců na kortikoidech. (Nyní byla ale opakovaně zamítnuta EMA pro nedostatečný efekt.) Santhera bude také prezentovat svou práci na naší konferenci v Praze. Siderosdmd.com
Capricor - Cap-1002
Buněčná terapie - ze srdce zemřelého člověka kultivují a vytváří kmenové buňky. Tato studie už proběhla u jiných diagnóz (např. u infarktu či u srdečního selhání). Již víme, že je lék bezpečný a vidíme pozitivní efekt. Nyní běží studie u DMD, bohužel pouze v USA, protože legislativně je poměrně složité provádět buněčnou terapii (kmenovými buňkami) v jiné zemi, obzvlášť v EU.
Kromě prezentace léků ve vývoji byla konference především plná setkání. Letos jsme se také hodně ptali na psychologickou péči v různých zemích, konference se s námi zúčastnila také psycholožka Mgr. Simona Dejdarová, kterou zajímalo, jak je nastavená psychologická péče o chlapce s DMD v jiných zemích. Ve většině zemí není k dispozici specializovaná péče o chlapce s diagnózou DMD, nicméně stát hradí psychologickou péče v případě potřeby (když uzná ošetřující lékař za vhodné). Tomuto systému se vymyká Itálie, kde mají při nervosvalových centrech psychologické týmy, které jsou rodinám k dispozici kdykoliv potřebují, zároveň doprovází rodinu při sdělení diagnózy a zařizují každoroční evaluaci možných poruch pozornosti, učení, chování. V Izraeli například mají zase skupinovou terapii, rodiny s DMD chlapci mají možnost se pravidelně setkávat.
Nedělní odpoledne bylo věnované setkání World Duchenne Organization a tématem bylo zaprvé srovnání úhrady jednotlivých částí péče v členských zemích WDO a jednak mezinárodní zapojení v klinických studiích, která zatím moc neprobíhá. Výsledky studie o srovnání úhrady vyjdou brzy v odborném časopisu. Nicméně nejvíce proplacených pomůcek mají Spojené království, Francie, Švédsko, Portugalsko a Izrael. ČR se pohybovala zhruba uprostřed žebříčku zemí (14. místo z 25 zemí, které odpovídaly). Další otázkou v dotazníku bylo, k jakým specialistům mají rodiny přístup. Nejméně mělo přístup ke specialistům na léčbu bolesti a rehabilitačnímu doktorovi. Nejvíce ke kardiologovi a pneumologovi. Velmi překvapivé byly výsledky otázky na dostupné léky. Translarnu má k dispozici pouze 60% dotazovaných, deflazacort 80%, ACEinhibitory 84%. Ostatní výsledky z celkem cca 25 otázek zpracuje World Duchenne Organization do článku.
Vypracovala MUDr. Karolína Češková



