Co je exon skipping?
29. března 2017
Exondys 51
= eteplirsen, lék vhodný pro pacienty, kteří mají potvrzenou mutaci přístupnou skippingu exonu 51. Tato mutace postihuje asi 13% pacientů z celkové populace.
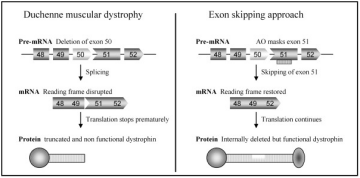
Co je exon skipping?
Jedná se o metodu, založenou na přeskočení úseků dystrofinového genu s vadnou genetickou informací, čímž je umožněna tvorba alespoň částečně funkčního dystrofinu. K této metodě lze použít oligonukleotidy, jež vyblokují kus dystrofinového genu v blízkosti poškozeného místa.
Americká FDA (Food and Drug Administration) schválila tento lék 19.9.2016 procesem zrychleného schvalování. Klinický přínos Exondys 51, který zahrnuje také zlepšení motorické funkce, nebyl prozatím stanoven. Ten musí firma Sarepta Therapeutics ještě ověřit ve studii. V případě, že nebude schopna ověřit klinický přínos, může FDA zahájit řízení vedoucí k odnětí schválení. Exondys 51 byl hodnocen ve třech klinických studií u pacientů, kteří mají vhodnou mutaci. Posuzování probíhalo pomocí 6MWT a svalové biopsie
Způsob podávání:
lék je určen k nitrožilní aplikaci – v infuzi po dobu 35-60 minut po předchozím naředění. Jedná se o čirý, bezbarvý roztok, který může mít opalescence. Neobsahuje žádné konzervační látky.Je k dispozici o síle:
100 mg / 2 ml (50 mg / ml)
500 mg / 10 ml (50 mg / ml)
Podává se v dávce 30 mg/kg tělesné hmotnosti jednou týdně. Po vynechání dávky se aplikuje co nejdříve.
Kontraindikace: žádné.
Nežádoucí reakce: nejčastěji poruchy rovnováhy a zvracení.
Exondys 51 v Evropě: začátkem roku 2017 začal přezkum u Evropské lékové agentury (EMA) o podmínečném schválení eteplirsenu. CHMP (výbor pro humánní léčivé přípravky) schválilo žádost o registraci. Posuzování trvá standardně 210 dnů, tedy konečné rozhodnutí o léku v Evropské unii se očekává na konci roku 2017.
Zdroje:
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm521263.htm
Zlatý standard péče o pacienty s DMD/BMD. Vrchlabí: Parent Project, c2007. ISBN 978-80-254-0433-1
www.accessdata.fda.gov/drugsatfda_docs/label/.../206488lbl.pdf
